Salze, Mineralstoffe, Mineralien, etc.
Umgangssprachlich versteht man unter dem Begriff „Salz“ das jedem bekannte Koch- oder Speisesalz, wobei dieses nach landläufiger Meinung aus der chemischen Verbindung Natriumchlorid (NaCl) besteht. Dies ist aber nur bedingt richtig. Erstens besteht unser Speisesalz nur zu ca. 97 % aus Natriumchlorid, der Rest verteilt sich auf andere Salze, sowie verschiedene Zusatzstoffe. Zweitens versteht der Chemiker unter dem Begriff Salze alle chemischen Verbindungen welche aus positiv geladenen Ionen (Kationen) und negativ geladenen Ionen (Anionen) aufgebaut sind und nicht nur speziell NaCl.
Salze sind im Allgemeinen mehr oder weniger harte Feststoffe, die sich allerdings meist leicht in Wasser auflösen. Bei diesem Lösevorgang spalten sich die Salze in die entsprechenden Ionen auf, die dann auch die entsprechenden „elektrischen“ Ladungen tragen. Dieser Vorgang wird vom Chemiker als Dissoziation bezeichnet und wird nachfolgend an einigen Beispielen erläutert. Es kann also gesagt werden, dass unser Aquarienwasser nichts anderes ist als eine Lösung von verschiedenen Salzen in Wasser, diese Salze, auf Grund der Dissoziation, im Wasser dann als positiv und negativ geladene Ionen vorliegen und dadurch die Eigenschaften des Wassers bestimmen.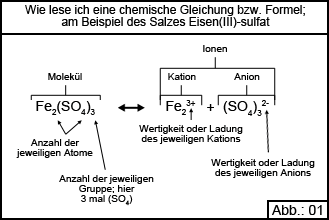 Bevor wir die Dissoziation an Hand einiger Gleichungen erklären, möchten wir am Beispiel des Salzes Eisen(III)-sulfat vermitteln, wie chemische Formeln im Allgemeinen gelesen werden und wie die einzelnen Komponenten bezeichnet werden. Abbildung 01 stellt im Prinzip an Hand einer Gleichung dar, was passiert, wenn Eisen(III)-sulfat in Wasser aufgelöst wird. Folglich spricht der Chemiker hier von einer sogenannten Dissoziationsgleichung.
Bevor wir die Dissoziation an Hand einiger Gleichungen erklären, möchten wir am Beispiel des Salzes Eisen(III)-sulfat vermitteln, wie chemische Formeln im Allgemeinen gelesen werden und wie die einzelnen Komponenten bezeichnet werden. Abbildung 01 stellt im Prinzip an Hand einer Gleichung dar, was passiert, wenn Eisen(III)-sulfat in Wasser aufgelöst wird. Folglich spricht der Chemiker hier von einer sogenannten Dissoziationsgleichung.
Weiterhin wird unterschieden zwischen Atomen, wie z. B. Natrium (Na), Calcium (Ca), Eisen (Fe), auch als chemische Elemente bezeichnet, und Molekülen, auch umgangssprachlich als chemische Verbindungen bezeichnet, wie z. B. Natriumchlorid (NaCl), Calciumcarbonat (CaCO3), Eisensulfat (FeSO4). Wobei die Bezeichnung Eisensulfat eigentlich falsch ist, aber dazu später mehr unter dem Begriff der Wertigkeit.
In den meisten Fällen ist ein Molekül immer die chemische Verbindung von zwei oder mehr unterschiedlichen Atomen. In einigen Fällen ist auch die Verbindung von zwei gleichen Atomen möglich, wie z. B. Sauerstoff (O2) oder Stickstoff (N2). Im Allgemeinen erscheinen sowohl Atome als auch Moleküle nach außen gesehen als neutral. Die bei der Dissoziation enstehenden Produkte werden als Ionen bezeichnet und je nach Ladung unterscheidet man in Kationen mit positiver Ladung und in Anionen mit negativer Ladung. Der in der Gleichung enthaltene Doppelpfeil sagt aus, dass dieser Vorgang umkehrbar, also reversiebel ist.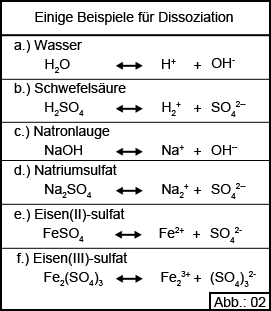 Oben wurde gesagt, dass Salze in Wasser der Dissoziation unterliegen. Diese Aussage trifft auch auf andere chemische Verbindungen zu, wie z. B. Säuren und Laugen, ja sogar vom Wasser selbst kann gesagt werden, dass ein Teil davon dissoziiert vorliegt. Abbildung 02 veranschaulicht dies an Hand der entsprechenden Dissoziationsgleichungen. Vereinfacht kann gesagt werden, dass Salze immer das Reaktionsprodukt aus einer Säure und einer Lauge darstellen.
Oben wurde gesagt, dass Salze in Wasser der Dissoziation unterliegen. Diese Aussage trifft auch auf andere chemische Verbindungen zu, wie z. B. Säuren und Laugen, ja sogar vom Wasser selbst kann gesagt werden, dass ein Teil davon dissoziiert vorliegt. Abbildung 02 veranschaulicht dies an Hand der entsprechenden Dissoziationsgleichungen. Vereinfacht kann gesagt werden, dass Salze immer das Reaktionsprodukt aus einer Säure und einer Lauge darstellen.
Wie Sie sicherlich bemerkt haben ist in Abbildung 02 Eisensulfat 2-mal aufgeführt und zwar einmal als Eisen(II)-sulfat und einmal als Eisen(III)-sulfat. HIeraus ergibt sich die Tatsache, dass ein Element durchaus auch in mehreren unterschiedlichen Ladungszuständen vorliegen kann. Der Chemiker spricht hier von unterschiedlichen Wertigkeiten. Im Beispiel des Eisensulfates spricht der Chemiker einmal von 2-wertigem Eisen, als Eisen(II)-sulfat bezeichnet und von 3-wertigem Eisen, als Eisen(III)-sulfat bezeichnet.
Abbildung 03 zeigt diese Zusammenhänge nicht nur am Beispiel der entsprechenden Summenformeln, sondern auch, zum besseren Verständnis, an Hand der entsprechenden Strukturformeln. Die Tatsache, dass ein Element in unterschiedlichen Wertigkeiten vorkommen kann, ist gerade in der Aquaristik von sehr großer Bedeutung.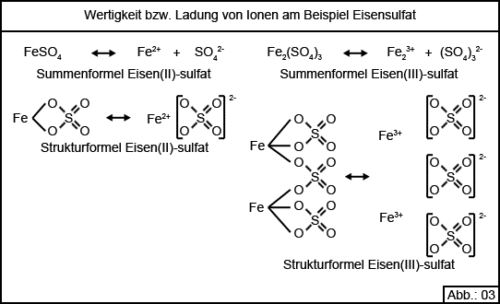
Wasserpflanzen können sehr leicht 2-wertiges Eisen, Fe2+, verarbeiten. Die Verarbeitung von 3-wertigem Eisen, Fe3+, ist für Wasserpflanzen jedoch nahezu unmöglich. Das oben gesagte, trifft nicht nur auf das Element Eisen zu, sondern auch noch auf andere, für das Pflanzenwachstum relevante Elemente. Leider ist es jedoch so, dass Elemente die in unterschiedlichen Wertigkeiten vorliegen können, sehr leicht von einem niedrigen Ladenzustand in einen höheren Ladungszustand übergehen und somit der Wasserpflanze nicht mehr zugänglich sind. Der Übergang von einer nierigen in eine höhere positive Wertigkeit wird allgemein gesagt als Oxidation bezeichnet. Dieser Vorgang wird dadurch verhindert, dass den verschiedenen Düngern sogenannte Komplexbildner, auch Gelatoren genannt, zugesetzt werden, welche die entsprechenden Elemente über lange Zeit in einer für die Wasserpflanzen verarbeitbaren Form vorrätig halten. Vereinfacht können Komplexbildner als relative große Moleküle bezeichnet werden, welche die entsprechenden Elemente umschließen, so dass diese nur schwer ihren Ladungszustand ändern können. Somit sollte z. B. auf jedem Eisendünger der Hinweis vorhanden sein, dass das Eisen in einer für die Wasserpflanze verwertbaren Form, auch über einen längeren Zeitraum, angeboten werden kann.
Ebenso dürfte es jedem Aquarianer klar sein, dass die Aussage, „Mein Aquarienwasser hat einen Eisengehalt von 0,05 mg/l“, eigentlich nichtssagend ist, da keinerlei Aussage gemacht wird, wieviel des Eisens als 2-wertiges Eisen vorliegt. Im Umkehrschluss muss natürlich auch bei der Analyse des Eisens bekannt sein, welches Eisen erfasst wird und wie mit komplexgebundenem Eisen verfahren wird. Allein die Angabe des Gesamteisengehaltes ist sinnlos, da keinerlei Aussage darüber gemacht wird, wieviel Eisen in einer für die Pflanzen verwertbaren Form vorliegt.
Unter Mineralstoffen, die fälschlicherweise im allgemeienen Sprachgebrauch oft auch als Mineralien bezeichnet werden, werden anorganische Nährstoffe verstanden, die der Organismus nicht selbst herstellen kann, ihm also von außen mit der „Nahrung“ zugeführt werden müssen. In der Aquaristik wird diese „Nahrung“ meist in Form von gelösten Salzen als Dünger für Pflanzen, in der Meerwasseraquaristik als „Nahrung“ für Korallen, Niedere Tiere, etc., verabreicht.
Zusammenfassend kann folgendes gesagt werden:
Salze sind das Reaktionsprodukt einer Säure mit einer Lauge. Salze bilden in wässriger Lösung sogenannte Kationen und Anionen. Die Art der im Wasser gelösten Salze, bzw. deren Ionen sind maßgeblich für die Wasserqualität und somit für die Eignung als Aquarienwasser verantwortlich. Mineralstoffe sind anorganische Nährstoffe, die Wasserpflanzen nicht selbst herstellen können, sondern von außen zugeführt werden müssen. Salze, bzw. deren Ionen sind anorganische Nährstoffe die mittels Wasserpflanzendünger den Wasserpflanzen in geeigneter Form zur Verfügung gestellt werden.
